原子量 – 分子量 | 質量と物質量の関係を解説

" 原子量 – 分子量 “について、質量と物質量の関係を解説しています。
比を通じての数学的な対応が背景になるので、内容をしっかりと理解することで、高校の化学を通じて数学のトレーニングにもなるかと思います。
「1 個あたりの重さ」という算数で学習した単位あたりの量の内容を、原子や分子について、大きな数について考えることになります。
まずは原子量について、質量とのつながりを解説します。
その後で、同様に分子量について述べ、物質量と化学反応式について解説を進めています。
原子量 – 分子量 :質量とのつながりから
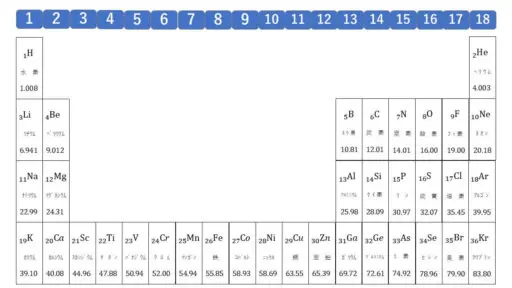
【原子量】
O = 16 を例にして解説します。
化学の教科書などに載っている原子量についての一覧です。
これから、この表に記されている原子量をどのように使うのかということについて解説を進めます。
高校の化学では、個数についての単位を使います。
6.02×1023個(アボガドロ数)だけ粒子が集まったとき、
1 mol という単位で表します。
この単位が物質量です。
O = 16 が、物質量とどう関わっているのかを押さえておくと、落ち着いて化学の計算問題を解くことができます。
原子量の一覧に記されている数字は細かいので、たいていは O は 16 として使われます。
6.02×1023個の酸素原子が集まると、その質量が 16g ということを意味しています。
つまり、1 mol の O 原子の質量が 16 g ということです。
これが、1 mol あたりの質量が 16 g という単位あたりの量の関係になります。
高校の化学で言うところのモル質量になります。
算数で学習したように、単位あたりの量の背景となる数学の内容は比です。
1 mol : 16 g という比例の関係になっています。
O 原子の質量と、O 原子の個数が比によって、つながっているということを押さえておくと、機械的に計算をすることができます。
物質量を交えているので、mol を個数に変換することが大切になります。
少し具体的な数字で見てみます。
練習問題1
O 原子たちの質量が 48 g のとき、それらの個数を求めてください。
<解答・解説>
まず、比の関係を考えます。
a mol の O 原子たちの質量が 48 g だとして、a の値を求めます。
1 mol : 16 g
= a mol : 46 g という比例の関係になっています。
ここで、内項の積と外項の積の値が等しいということを使います。
16×a = 1×48 より、
16a = 48 です。
そのため、
a = 48÷16 = 3 です。
これで、3 mol の O 原子の質量が 48 g ということが分かりました。
ここから、mol という物質量を個数の単位に変換します。
1 mol が 6.02×1023個に相当します。
この変換も比です。
求める 3 mol の O 原子の個数を t 個とすると、
1 mol : 6.02×1023
= 3 mol : t です。
よって、
t = 3×6.02×1023
= 18.06×1023 となります。
ゆえに、
質量 48 g の O 原子たちの個数は、
18.06×1023個です。
このように、質量・物質量・個数を比で関連づけられるようになると、同じ要領で分子についての個数と質量の関係を考えることができます。
原子が複数個で結合して分子を形成しているということから、さらに議論を進めます。
原子量 – 分子量 :分子1モルあたりの重さ

O 原子 2 個が結合して、O2 という酸素分子 1 個になります。
分子の個数についても、
同じく 6.02×1023個を 1 mol とします。
ただし、分子の mol 数と、その分子を形成している原子の個数は異なるので注意です。
個数について、分子の個数と原子の個数のちがいを確かめておきます。
O2 という酸素分子が 2 mol あったとします。
つまり、
O2 分子が 12.04×1023個あるということです。
このとき、これらの分子を形成するのに用いている原子の個数を考えます。
O 原子 2 個が結合して、O2 という酸素分子 1 個なので、
O2 分子が 12.04×1023個あるということは、
O 原子が 2×(12.04×1023)個あるということになります。
まとめると、
O2 という酸素分子が 2 mol あると、
O 原子が 4 mol あり、
それらは 24.08×1023個ということになります。
このように、分子の個数と、その分子を形成している原子の個数には、ちがいがあるので、どの数字を考えているのかは意識しておかなければなりません。
ただ、同じ比例の関係なので、落ち着いて確認をすれば正しい値が計算できます。
分子量と質量について
O = 16 が 2 個で酸素分子です。
そのため、O2 = 32 です。
この 32 を酸素分子の分子量といいます。
ここまで来ると、原子のときと同じく分子の質量を考えることができます。
O2 が 6.02×1023個だけ集まったときの質量が 32 g ということです。
このことを物質量を使って表すと、
O2 が 1 mol だけ集まったときの質量が 32 g ということになります。
これで原子のときと同様にして、分子レベルで個数と物質量と質量を考えることができます。
【練習問題2】
酸素分子 a mol の質量が 96 g だとします。
このとき、a の値を求めてください。
<解答と解説>
酸素分子 O2 = 32 でした。
1 mol の酸素分子が集まると質量が 32 g ということなので、比の関係を使って a の値を求めます。
1 mol : 32 g
= a mol : 96 g
よって、
32a = 96 より、
a = 3 となります。
このように、質量と物質量の関係を押さえておくと、物質量から分子の個数も計算することができます。
今、酸素分子が 3 mol ですから、これらの酸素分子の個数も求まります。
1 mol : 6.02×1023個 という比例の関係なので、物質量が 3 mol のときの個数は、3 倍すると求まります。
18.06×1023個が酸素分子 3 mol の個数ということになります。
ちなみに、O2 は O 原子が 2 個で 1 つですから、酸素分子 3 mol を形成するのに使われている O 原子の個数は、酸素分子の個数の 2 倍になります。
つまり、36.12×1023個の酸素原子が 3 mol の酸素分子を形成するのに使われています。
物質量と化学反応式
【水素の燃焼】
2H2+O2 → 2H2O
中学の理科で学習する水素が燃焼して水ができるときの化学反応式です。
この化学反応式の各係数ですが、反応前後に関わる分子たちの物質量のモル比になっています。
左辺について、H2とO2の係数が 2 と 1 です。
これは、反応前に使われる水素の物質量と酸素の物質量の比が 2 対 1 の割合ということを意味しています。
例えば、3 mol の H2が完全に燃焼して水ができたとします。
このときに、反応した酸素の物質量を a mol とすると、計算で求めることができます。
2 : 1 = 3 :a という関係なので、
2a = 3 より、
a = 1.5 (mol) と計算で求めることができます。
反応後の H2O の係数は H2 の係数と同じ 2 です。
そのため、反応する水素の物質量と、反応後にできる水の物質量の比は 2 対 2 です。
2 : 2 の比を簡単にすると、
1 : 1 なので、化学反応の前後の水素と水の物質量は同じということになります。
そのため、3 mol の水素が完全に燃焼したとすると、できる水の物質量も同じ 3 mol ということになります。
このように、モル計算ができると、反応前後の水素、酸素、水の質量の変化をモルを通じて比で計算して求めることができます。
※ 比の相等という記事で比についての数学的な基本事項を解説しています。
中学の理科では、物質量について学習をしていませんでしたが、高校の化学ではモル比を通じて質量の変化を計算することが多いです。
各化学反応式の係数の比が、質量の比ではなく、モル比なので早く計算に慣れておくのが良いかと思います。
少し練習をしてみます。
モルを通じて考える
【練習問題】
2H2+O2→ 2H2O
酸素 96 g が完全に反応したとき、反応後にできる水の質量を求めてください。
O2 = 32 という分子量なので、96 g という酸素の質量を物質量に直します。
96÷32 = 3 より、
反応した酸素は 3 mol ということになります。
次に、O2 と H2O の係数が 1 対 2 ということから、反応に使われた酸素の物質量の 2 倍の物質量が反応後にできる水の物質量ということが分かります。
よって、3×2 = 6 なので、
6 mol の水 H2O ができるということになります。
求めたいのは、水分子の質量なので、6 mol を g の単位へと直します。
H2O = 18 が分子量なので、1 mol あたりの質量が 18 g です。
今、6 mol の水分子なので、求める質量は 18 g の 6 倍です。
すなわち、
18×6 = 108 g が反応後にできる水の質量です。
このように、化学反応式の係数がモル比になっています。
そのため、化学反応式の係数を正確に決定することが大切になります。
この係数に関して、化学の基礎的な知識をもとに、等式を考えることに慣れておくと計算で求めることができます。
反応前後の原子の数に注目
2H2+O2→ 2H2O について、
反応前と反応後の各原子の個数が同じということを確認しておきます。
2H2というのは、水素分子 H2 が反応前に 2 個あるということを意味します。
原子の個数レベルで見ると、1 個の水素分子は 2 個の水素原子で形成されているので、反応前の水素原子の個数は 4 個ということになります。
2×2 = 4 という計算です。
反応後の 2H2O は、水分子が 2 個あるということです。
1 個の水分子には 2 個の水素原子が使われているので、反応後の水素原子の個数は 4 個です。
まとめると、反応前の水素原子の個数は 4 個で、反応後の水素原子の個数も 4 個です。
このように、反応前と反応後の原子の個数は一致するという化学の知識は基本となります。
慣れるために、酸素原子 O についても個数が反応前後で一致していることを確かめておきます。
反応前は O2 なので、
1×2 より、2 個の酸素原子があるということになります。
反応後は 2H2O なので、
2×1 より、2 個の酸素原子です。
やはり、反応前後で酸素原子の個数は一致しています。
この原子の個数が反応の前後で一致するということを数学の記号で等式を用いて表します。
そうすることで、比の関係を考えながら化学反応式の係数を決定できます。
xH2+yO2→ zH2O という状態から化学反応式の係数を求めてみます。
水素原子について、反応前後の個数が等しいことから、次のように等式が成立します。
2x = 2z …①
酸素原子についても、同様に等式が成立しています。
2y = z …②
ここで、化学反応式の係数がモル比だったということを考えます。
比なので、それぞれが何倍にあたるのかを示しているわけです。
そのため、どの係数でも良いので、基準となる個数を 1 と置きます。
こうすることで、文字を 1 つ減らして等式を扱うことができます。
x = 1 と置くことにします。
すると、①より、
2 = 2z だから、
z = 1 …③
これを②に代入すると、
2y = 1 より、
y = 1/2 …④
x = 1 と③、④から、
x : y : z
= 1 : 1/2 : 1 となります。
化学反応式の係数は自然数なので、比に分数が出てきたときは、簡単にして自然数だけが現れるようにしておきます。
2 倍すると、
1 : 1/2 : 1
= 2 : 1 : 2 です。
これで、
x : y : z
= 2 : 1 : 2 と、すべて自然数を値とする形で比が求まりました。
この比が化学反応式の各係数となっています。
2H2+O2→2H2O の 2 と 1 と 2 です。
化学反応式の係数はモル比となっているので、高校の化学の計算問題を解くときに、よく使うので慣れておくと良いかと思います。
【理科の記事】
■ モル濃度
■ ラウールの法則
※ 物理基礎について、運動方程式という記事も投稿しています。
それでは、これで今回の記事を終了します。
読んで頂き、ありがとうございました。